- 学科导航
获批前列腺癌治疗药物的进展
|
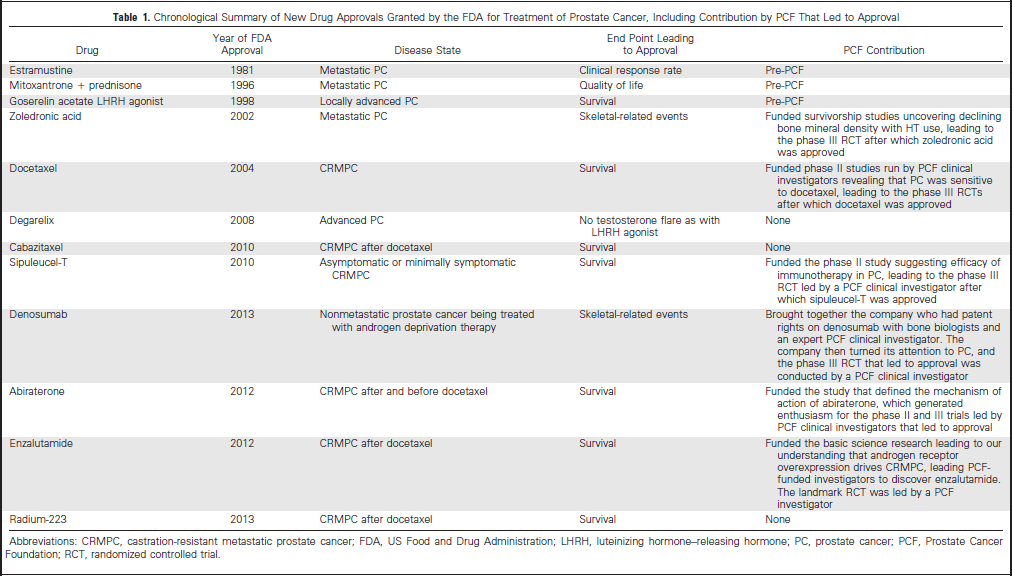
2002年之前,只有三种药物被FDA批准用于治疗前列腺癌(PC),并且这些药物中只有一种是以随机临床试验(RCT)生存期的延长为依据。从那时起,药物数量已增加到12种,几乎所有的新药批准(NDAs)都通过随机临床试验记录生存率。到现在具体都有了哪些改变?
1993年,在一个名为前列腺癌基金会(PCF)的新成立机构的组织下,其前身为前列腺癌治疗协会(CaP CURE),带领前列腺癌治疗科学和临床学专家聚集在一起,利用PCF的资源去寻找一种新的方法,为晚期前列腺癌确诊患者促进新的治疗手段和改善预后。最初,这些重要的资源是通过这个机构的创建者兼主席,Michael Milken提供的,他在1993年被诊断为前列腺癌。而后,由PCF举行了一次大型筹款活动作为维持正在进行的研究活动的收入源。迄今为止,5.1亿美元已经用于前列腺癌的研究,使这个机构成为世界上最大的前列腺癌研究私人赞助商,资助16个国家近200个研究中心的1600多个研究项目。
唑来膦酸的新药批准是FDA在2002年公布的。这是首个能降低骨相关事件(例如压缩性骨折)的药物,在随机临床试验中,该药物对转移灶原发部位是骨骼的前列腺癌患者有效。这项随机临床试验最初是由PCF资助的存活率研究,该项研究阐明了在前列腺癌治疗中降低骨质密度和激素疗法之间关系。
然后,PCF临床协会的临床研究们帮助我们认识到前列腺癌对紫杉烷类化疗方案敏感(例如,多西他赛),多西他赛是FDA在两项随机临床试验公布后于2004年批准的。其中的一项随机临床试验是由PCF的研究者指导的,并且该试验表明可以改善去势转移性前列腺癌患者的存活。
随着进一步发展,在前列腺癌新药批准的新时期,2008年批准的地加瑞克(degarelix)单一用药有可能避免睾丸素增加,它是一种纯粹的促黄体素释放激素拮抗剂。
最近,在2010年和2011年,三种用于前列腺癌患者的新药通过FDA批准:sipuleucel-T(Provenge),首次使用免疫治疗来刺激机体免疫系统,延长生存期,值得注意的是,不存在前列腺特异性抗原反应;Jevtana(cabazitaxel),另一种紫杉烷类化疗药,可以延长多西他赛治疗出现疾病进展后患者的生存期;最后一种是在2011年9月16日FDA批准的Xgeva (denosumab),对接受去势疗法治疗的非转移性前列腺癌存在高风险骨折的患者,是增加骨质的一种治疗。
在最近的两年,醋酸阿比特龙(abiraterone acetate)和恩杂鲁胺(Enzalutamide),两种新的激素治疗形式已经在多中心随机临床试验中证明,对去势转移性前列腺癌患者可以延长存活期并改善患者报告的健康相关生活质量,这两种药物已被FDA批准,目前正在由世界各地的合作小组进行疾病的早期试验。人们期望的是这些药物可以增加新近被诊断出高风险和非转移性前列腺癌患者治疗的可能性。PCF在确定这些药物作用机制方面发挥了重要作用,并且在一定情形下,支持这项研究以至于发现了这种药物。在这两种条件下,PCF临床研究者带领这些随机临床试验获得FDA批准。
最近的一次,在2013年5月15日,第一个放射性药物镭233,被发现可以延长前列腺癌和对常规内分泌治疗无效的骨转移患者的生存期。通过骨中选择性吸收和带电粒子(即,α粒子)的短距离活动,对周围造血组织的损坏是最小的。
因此,2002年后出现的这九种新药批准,有六种是通过PCF存在的研究和合作驱动的。如今,随着癌症研究的联邦资助计划持续降低,迫切需要的新模式,比如利用PCF资助研究获得新药批准,对于所有的癌症都是必要的。
编译自:US Food and Drug Administration Approval of Drugs for the Treatment ofProstate Cancer: A New Era Has Begun,JOURNAL OF CLINICAL ONCOLOGY,December 16, 2013 |

热门新闻
- 阅读
- 评论
推荐阅读
-
儿童感染后用什么药?哪些情况需要就医?北
儿童感染新冠病毒的症状、病程有何特点?退烧药怎么选、怎么吃?孩子出现何种症状需立[详细]
-
国务院最新公布:我国医养结合面临问题和下
导语医养结合将成为下一个风口!在日前召开的第十三届全国人大常委会第三十六次会议上[详细]
-
版权所有:北京英芙麦迪科技有限公司
地址:北京市顺义区竺园二街2号院8号楼301(天竺综合保税区)
电话:(010)-80489293-6011 邮件:hmp@bjhanmi.com.cn
-
 互联网药品信息服务资格证书 京ICP备07502511号-4
互联网药品信息服务资格证书 京ICP备07502511号-4药品医疗器械网络信息服务备案 (京)网药械信息备字(2022)第00010号
(京)-非经营性-2019-0001
 京公网安备11011302001972
京公网安备11011302001972

 收藏
收藏






