- 学科导航
[ISC2014]CLEAR III试验:评估脑室内出血加速消退试验
|
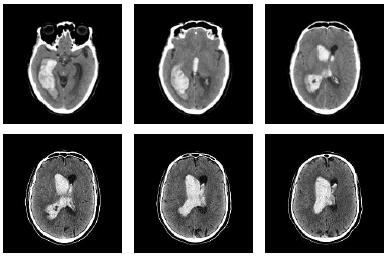
CLEAR III是一项III期随机对照试验,旨在少量颅内出血(<30cc)及大量脑室内出血(IVH)(第三或第四脑室内的血流阻塞)的患者中比较使用脑室外引流术及使用rt-PA或安慰剂治疗的效果。
研究概述
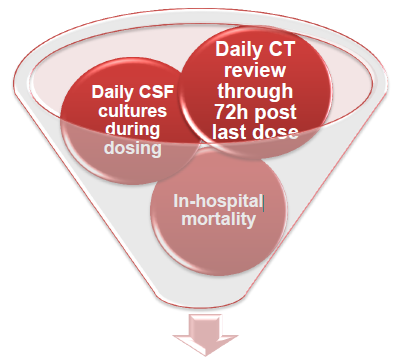
该研究预先设定的安全性终点阈值:每天行CT检查,72小时内发现症状性出血(如出血面积扩大,新发出血灶及导管内出血)(35%);1~7天每天进行脑脊液(CSF)培养,30天内随机出现的大脑感染(15%);系统报告30内患者的死亡率(30%)。
患者进展的系统性报告与SAE报告
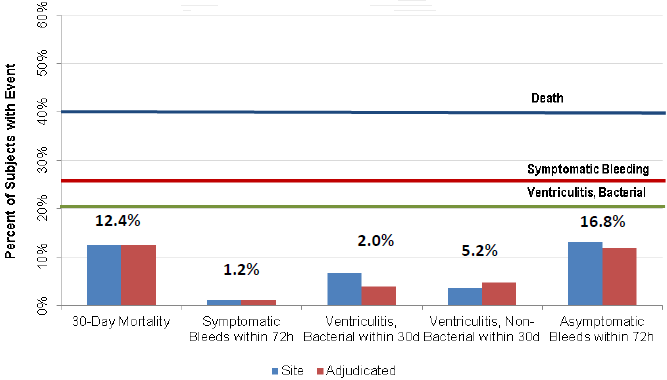
纳入研究的患者来自61个不同地点,筛选过程持续34.63个月。安全性事件为:研究药物给予72小时内有3例(1.2%)患者出现症状性出血,5例(2%)患者出现细菌性脑室炎,13例(5.2%)出现无细菌性脑室炎,最终在30天内死亡的有31例(12.4%)。
30天内,共有48例(19.2%)患者出现脑出血,其中6例(2.4%)为症状性脑出血,42例(16.8%)为无症状性脑出血。在这48例患者中,有39例导管内出血,5例脑室内出血,2例脑实质出血和2例蛛网膜下腔出血。在给予药物72小时内发生颅内出血的35例患者中,有23例(65.7%)是在预防性肝素应用时发生的,只有1例为症状性出血。
研究过程中有37例患者(14.8%)深静脉血栓形成(DVT),8例(3.2%)肺栓塞(PE);有16例(43.2%)患者在诊断后平均231.04小时内开始应用预防性肝素。在213例无DVT的患者中,有151例(70.9%)接受了肝素治疗,62例(29.1%)未接受肝素治疗。此外,有259例严重不良反应事件(SAE),其中有19例(7.3%)可能与研究药物相关;有13例缺血性卒中患者;53例(21.2%)患者进行了脑室-腹腔分流术。
终点频率及阈值 研究总结:
▶ 入选CLEAR III试验的250名受试者未达到预先设定的安全性阈值 ▶ 该试验的死亡率、出血及感染终点低于预期,表明该研究方案于严重IVH患者是安全的 ▶ 预防性肝素给药时和给药后颅内出血风险升高 ▶ 那些没有接受预防治疗 [每一个研究方案]的患者出现血栓事件的可能性更大 ▶ 脑室内rtPA治疗不是现行的治疗标准 ▶ Clear III试验的目标 - 有效性/安全性 ▶ 保证安全性需严格遵照以下几个方面:1)出血稳定;2)合并用药;3)密切监测不良事件
来源:医脉通综合
|

热门新闻
- 阅读
- 评论
推荐阅读
-
儿童感染后用什么药?哪些情况需要就医?北
儿童感染新冠病毒的症状、病程有何特点?退烧药怎么选、怎么吃?孩子出现何种症状需立[详细]
-
国务院最新公布:我国医养结合面临问题和下
导语医养结合将成为下一个风口!在日前召开的第十三届全国人大常委会第三十六次会议上[详细]
-
版权所有:北京英芙麦迪科技有限公司
地址:北京市顺义区竺园二街2号院8号楼301(天竺综合保税区)
电话:(010)-80489293-6011 邮件:hmp@bjhanmi.com.cn
-
 互联网药品信息服务资格证书 京ICP备07502511号-4
互联网药品信息服务资格证书 京ICP备07502511号-4药品医疗器械网络信息服务备案 (京)网药械信息备字(2022)第00010号
(京)-非经营性-2019-0001
 京公网安备11011302001972
京公网安备11011302001972

 收藏
收藏






