- 学科导航
巴维昔单抗获得FDA快速跟踪身份
|
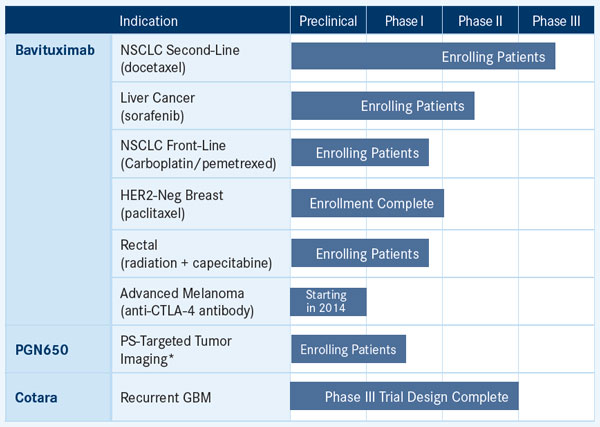
巴维昔单抗(bavituximab),Peregrine制药公司首个临床免疫治疗候选药物,获得了FDA快速跟踪身份揭开了2014年序幕。它是作为二线非小细胞肺癌(NSCLC)潜在治疗临床研发产品的最新里程碑。Peregrine系列也包括脑肿瘤制剂,Cotara,一种肿瘤坏死治疗(TNT)药物,在II期临床试验对已经复发的胶质母细胞瘤(GBM)患者治疗显示有希望。
去年12月,Peregrine制药公司开始为考察巴维昔单抗在二线非小细胞肺癌治疗作用的关键性III期SUNRISE试验招募。该项试验针对一线治疗后病情进展的IIIB/IV期非鳞状细胞NSCLC患者。参与者将被随机分配到2个治疗组。所有的患者接受六个周期,每个周期为21天多西他赛(75mg/m2)+每周注射巴维昔单抗(3mg/kg)或者安慰剂,直到病情进展或者出现毒性。本试验的主要终点是总生存期。这项试验会招募来自世界各地100多个医疗中心约600名患者。
巴维昔单抗是一种靶向磷脂酰丝氨酸(PS)的单克隆抗体,磷脂通常存在于细胞膜内侧(胞质一侧)。该磷脂是高度免疫抑制剂,以致当它翻转时,会暴露在沿着肿瘤血管的肿瘤细胞和细胞的外侧,这样可以躲避免疫检测。癌症治疗增加了细胞表面的PS暴露,从而进一步增加肿瘤环境的免疫抑制。巴维昔单抗靶向PS,同时阻断这种免疫抑制剂信号,而且巴维昔单抗已经被证明可以重新激活人体的免疫系统,恢复机体对肿瘤的识别和反应能力。
肿瘤坏死治疗
TNT制剂Cotara靶向实体瘤的核心发现的坏死细胞。它通过向肿瘤中心运输和键合放射性碘的工作原理,允许放射由内向外的摧毁肿瘤。
纳入了GBM复发的41例患者的II期试验中期数据显示中位总生存期9.3个月。此外,73%的患者存活6个月,38%的患者12个月,24个月存活的患者占19%。两例患者经Cotara单一治疗后存活3年。在此项试验中患者治疗已经完成,一线数据在2011年ASCO年度会议上的报告上提交。
根据手中的这些结果,Peregrine在2012年12月向FDA提交了Cotara治疗GBM复发患者的一项试验设计。FDA批准了提交的在高达300例患者中通过对比Cotara两个剂量水平的随机试验设计。Peregrine公司计划完成这项试验作为全球性注册研究的一部分,故会与其他监管机构协商。
I-124 PGN650
Peregrine制药公司正在进行涉及I-124 PGN650的临床前研究,I-124 PGN650结合了第一类PS-靶向F(ab’)2全人源单克隆抗体片段(PGN650)与PET显像的放射性同位素碘-124。根据FDA研究性新药申请,该公司已经展开了一项开放标签,单组肿瘤显像和放射量测定的研究。在这项研究中,I-124 PGN650单次静脉剂量将被给药到12例各种实体瘤患者中。研究人员将从关键和非关键器官,肿瘤成像和安全性方面评估放射剂量。
※根据FDA研究性新药申请备案的调查图
编译自:Peregrine’s Lead Agent Receives FDA Fast Track Designation for NSCLC,OncLive,Tuesday,March 4,2014 |

热门新闻
- 阅读
- 评论
推荐阅读
-
儿童感染后用什么药?哪些情况需要就医?北
儿童感染新冠病毒的症状、病程有何特点?退烧药怎么选、怎么吃?孩子出现何种症状需立[详细]
-
国务院最新公布:我国医养结合面临问题和下
导语医养结合将成为下一个风口!在日前召开的第十三届全国人大常委会第三十六次会议上[详细]
-
版权所有:北京英芙麦迪科技有限公司
地址:北京市顺义区竺园二街2号院8号楼301(天竺综合保税区)
电话:(010)-80489293-6011 邮件:hmp@bjhanmi.com.cn
-
 互联网药品信息服务资格证书 京ICP备07502511号-4
互联网药品信息服务资格证书 京ICP备07502511号-4药品医疗器械网络信息服务备案 (京)网药械信息备字(2022)第00010号
(京)-非经营性-2019-0001
 京公网安备11011302001972
京公网安备11011302001972

 收藏
收藏






