- 学科导航
FDA联手各方破解严重药物性肝损伤“迷局”
|
2014年3月19-20日,美国食品与药物管理局(FDA)/药物评价与研究中心(CDER)主办的第14届药物性肝损伤(DILI)专题研讨会在美国华盛顿的马里兰大学召开。中华医学会肝病学分会DILI学组的陈成伟和茅益民教授等10余位我国药物性肝病领域的资深学者受邀参会。
惨痛的1997年
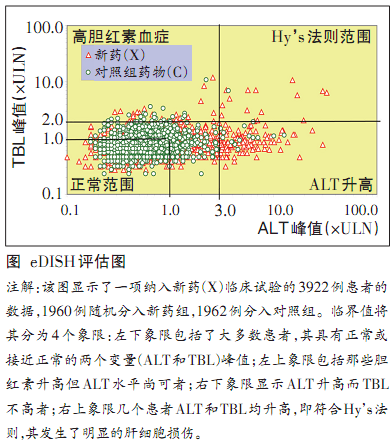
本届研讨会主席Senior博士谈到,美国DILI研讨会已经有15年历史,最早于1999年召开首届DILI研讨会,是源于1997年被批准上市的两个药物曲格列酮(troglitazone)和溴芬酸(bromfenac)引发了非常严重的肝衰竭,曲格列酮在临床试验2510名患者中丙氨酸氨基转移酶(ALT)>3倍正常值上限(ULN)发生率仅为1.9%,安慰剂组为0.6%,上市后导致89例肝功能衰竭,65例死亡。两个药物均遭撤市。 Hy’s法则与新评估工具eDISH程序的建立
1998年以来,FDA批准过的药物无一因肝损伤而撤出市场。2004年,FDA拒绝了希美加群(ximelagatran)的申请,2007年拒绝了罗美昔布(lumiracoxib)的申请。尽管这两种药物在欧洲获得批准,但后来发现,这两种药物在携带人类白细胞抗原(HLA)DRB1*0701或者HLA DRB1*1501敏感生物标志物的个体中可诱导肝毒性。
多方联手寻找突破口
面临的挑战与未来
来源:中国医学论坛报 |

热门新闻
- 阅读
- 评论
推荐阅读
-
儿童感染后用什么药?哪些情况需要就医?北
儿童感染新冠病毒的症状、病程有何特点?退烧药怎么选、怎么吃?孩子出现何种症状需立[详细]
-
国务院最新公布:我国医养结合面临问题和下
导语医养结合将成为下一个风口!在日前召开的第十三届全国人大常委会第三十六次会议上[详细]
-
版权所有:北京英芙麦迪科技有限公司
地址:北京市顺义区竺园二街2号院8号楼301(天竺综合保税区)
电话:(010)-80489293-6011 邮件:hmp@bjhanmi.com.cn
-
 互联网药品信息服务资格证书 京ICP备07502511号-4
互联网药品信息服务资格证书 京ICP备07502511号-4药品医疗器械网络信息服务备案 (京)网药械信息备字(2022)第00010号
(京)-非经营性-2019-0001
 京公网安备11011302001972
京公网安备11011302001972

 收藏
收藏






