- 学科导航
FDA:推荐DNA粪便检查作为直肠癌筛查手段
|
经过效益-风险评估,FDA分子和临床基因咨询委员会以10-0的投票一致通过了一项将DNA粪便检查-Cologuard检查作为结肠癌检查的提案。
Cologuard检查是一项DNA筛选工具。它涉及对KRAS突变,甲基化骨形态蛋白3(BMP3),N-Myc下游调节基因4(NDRG4)以及β-肌动蛋白的畸形进行定量分子检测。专家组的推荐是基于此前的一项关于Cologuard DNA检测与目前使用的粪便免疫化学检测(FIT)的对比研究结果显示Cologuard 检测比FIT更为有效。
该研究结果已发表在《新英格兰医学杂志》(NEJM)上。上周医脉通也报告了该项研究内容。
研究过程及结果
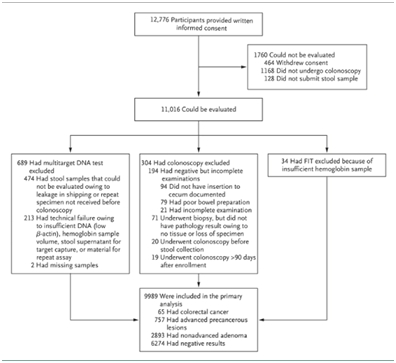
在该研究中,在2011年7月至2012年11月间对来自美国和加拿大各地的9989位平均结直肠癌患病风险的个人在90天的样品收集过程中进行结肠镜检查。研究地点包括私人诊所和学术中心。为了增加患癌的可能性,招募的都是大于等于65岁的老人。研究者强调,与以往研究不同的是,这项研究在很大程度上依赖于归档的粪便样品。
DNA和FIT的检查比测仪(OC FIT-CHEK, Polymedco)都以其检查灵敏度进行评价。灵敏度是以阳性率或有阳性结果的患病个体的比例来界定的。疾病包括:结直肠癌(如腺癌);发展的癌前期病变;高度发育不良息肉,≥1 cm锯齿状无柄息肉。
Figure 1. Enrollment and Outcomes
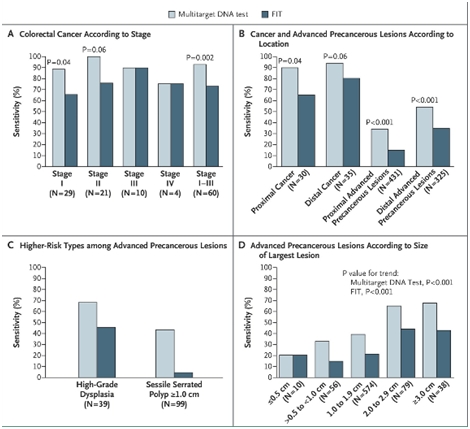
Figure2. Sensitivity of the Multitarget Stool DNA Test and the Commercial FecalImmunochemical Test (FIT), According to Subgroup 研究者对试验阐述说,大部分具有阳性结果受试者由于地的癌症相关性可能为假阳性。FIT的假阳性率为3.6% to至5.1%,而Cologuard则为10.2% to 13.4%。在接触镜检查中呈阴性结果的个体中,DNA检查的特异性很高—几乎为90%,但仍低于FIT对该组的特异性(>96%)。
在65例具有癌症的病人中,Cologuard发现了60例。DNA的灵敏性不会因癌症阶段或癌症所在结肠的位置而受到显著影响。需要进行结直肠癌筛查的,用结肠镜得到的该类人数为154,使用Cologuard与FIT分别为166和208。对于发展的癌前期病变的,三者人数分别为13,31, 55。
专家评价
北卡罗来纳大学医学教授David Ransohoff表示,结肠癌92%的检出率对于非入侵性检查是非常高的。因此阴性结果意味着没有必要进行进一步的如结肠镜的检查。如此高灵敏度非入侵性的检查手段对于结直肠癌的筛查具有重要意义。
发明Cologuard检查的公司的董事长Kevin T. Conroy表示,很高兴委员会强烈支持Cologuard通过批准。他希望能继续与FDA合作,完成Cologuard的审查,并承担满足结直肠癌筛查领域需求的任务。
编译自:Lauren M. Onclive,FDA Panel Unanimously Recommends NewDNA Stool Test, March 27, 2014 |

热门新闻
- 阅读
- 评论
推荐阅读
-
儿童感染后用什么药?哪些情况需要就医?北
儿童感染新冠病毒的症状、病程有何特点?退烧药怎么选、怎么吃?孩子出现何种症状需立[详细]
-
国务院最新公布:我国医养结合面临问题和下
导语医养结合将成为下一个风口!在日前召开的第十三届全国人大常委会第三十六次会议上[详细]
-
版权所有:北京英芙麦迪科技有限公司
地址:北京市顺义区竺园二街2号院8号楼301(天竺综合保税区)
电话:(010)-80489293-6011 邮件:hmp@bjhanmi.com.cn
-
 互联网药品信息服务资格证书 京ICP备07502511号-4
互联网药品信息服务资格证书 京ICP备07502511号-4药品医疗器械网络信息服务备案 (京)网药械信息备字(2022)第00010号
(京)-非经营性-2019-0001
 京公网安备11011302001972
京公网安备11011302001972

 收藏
收藏






